ドラッグ・ラグから「ドラッグ・ロス」が深刻な問題に
以下は、記事の抜粋です。
分子標的薬やがんゲノム医療の進化に伴い、特定の遺伝子変異を対象とした臓器横断的がん治療の時代が到来している。特にがん領域の分子標的薬の開発は目覚ましく、1997年には数えるほどだった承認薬数は2023年8月時点で161種類(64標的)に上る。これに伴い、日本では新たに「ドラッグ・ロス」が喫緊の課題になっているという。1月31日、日本臨床腫瘍学会が開催したプレスセミナーで、室圭氏(愛知県がんセンター薬物療法部部長)が解説した。
新しい薬が日本で使えなくなる
「ドラッグ・ロス」とは何か。欧米では承認されているが、日本では未承認なだけでなく、開発されていない新規有効成分を含有する医薬品に関連した問題を指す。
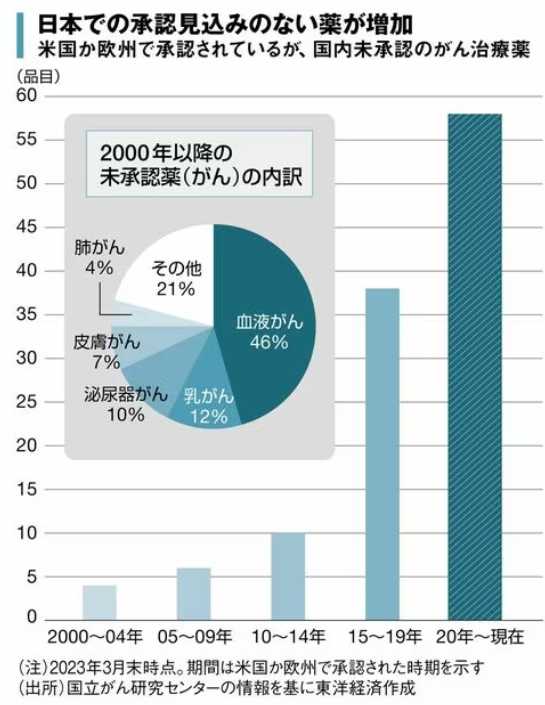
欧米で承認された新規有効成分を含む医薬品における国内未承認薬の割合は、2016年の56%から2017年からは再び62%に増加、その後も右肩上がりが続き2020年には72%(243品目中176品目)を占めるまでになっている。このうち、ドラッグ・ラグ(未承認なだけ)に該当する品目は81であるのに対し、ドラッグ・ロスに該当するのは91品目に上る。
なぜ、日本でドラッグ・ロスが起こるようになったのか。室氏は「かつてはグローバル企業が新規薬剤を開発して、国際共同治験を行っていたが、現在はベンチャー企業が開発を担って、それをグローバル企業が買い上げる流れに変化している」と指摘する。実際、2016-2020年にFDAで承認された60品目のうち、日本で承認された19品目の内訳は製薬企業16品目、ベンチャー企業3品目に対し、日本未承認の41品目中、製薬企業は19品目、ベンチャー企業は22品目を占めるようになっている。
ベンチャー企業開発の医薬品の承認が日本で遅い要因について、(1)日本に国内管理人がいない、(2)日本国内の承認プロセスが日本語対応のため、海外の申請内容をそのまま受け入れられないシステムになっている――を挙げる。「台湾や韓国では英語ベースでの国内開発が可能であるため、ドラッグ・ロスは起こっていない。これはかなり根深い問題と言える」(室氏)
今は乳がん、胃がん、大腸がんといった臓器別がんの大きなくくりでの臨床第3相試験はほとんどなくなって、頻度の少ない融合遺伝子を含む希少フラクションの疾患や小児、希少がんに対する開発品が非常に増えている。これらの開発をベンチャー企業が手がけるようになっており、アジア地域では韓国や台湾、香港に大きく遅れを取っている」と室氏。「人口減少局面を迎える日本ではその後の試験は難しくなっている。今のやり方では、ベンチャー企業の開発品が非常に増えている中で、未承認薬が非常に多く、かつ、臨床試験への組み入れができていない、承認につながらないという流れが浮き彫りになっている」と危機感を示す。
 ヒトのDNAの配列がわからず、「純粋の日本人」とかいう馬鹿な考えも通用した時代にできた「日本人に使う薬物は日本で臨床試験をしないと認めない」制度が残っています。日本の製薬企業の多くはこの既得権益に胡坐をかいています。希少疾患の場合、治療のために外国に行く例が増えるかもしれません。
ヒトのDNAの配列がわからず、「純粋の日本人」とかいう馬鹿な考えも通用した時代にできた「日本人に使う薬物は日本で臨床試験をしないと認めない」制度が残っています。日本の製薬企業の多くはこの既得権益に胡坐をかいています。希少疾患の場合、治療のために外国に行く例が増えるかもしれません。


コメント