mRNAワクチン:新型コロナウイルス感染を抑える切り札となるか?
日本RNA学会のホームページに掲載されている島根大学の飯笹 久氏が書かれた記事です。やや専門的ですが、良く書かれていていろいろな疑問が解決されました。以下は、抜粋です。
まずこのワクチンの新しい点を説明し、またmRNAワクチンを出しているBioNTech (ファイザー) 社とModerna社の製品の違い、最後に考えられる問題点ついても解説したい。
ウイルスのワクチンには弱毒化ウイルスを用いた生ワクチンと、不活性化ワクチンの2つがある。生ワクチンは強力な方法だが、弱毒化ウイルス株の樹立には長い時間を必要とする。また、病原性復帰という視点から考えると、今回のようなウイルスではこの方法は使うことができない。
不活性化ワクチンは、インフルエンザなどで用いられている。この場合、ウイルス粒子は感染できないので異物として認識され、抗原提示細胞 (マクロファージや樹状細胞) へ運ばれる。すると、液性免疫しか誘導されない。液性免疫のうちIgGしか産生誘導できないと、粘液に邪魔されて抗体がウイルスと結合できないので、感染を抑制できない。インフルエンザのワクチンなどの従来型の不活性化ワクチンは感染を止めることはできない。主に重症化を抑えることを目的としている。
新型コロナウイルスの場合、不活性化ワクチンで十分なのだが、それを作るのは容易ではない。新型コロナウイルスでは、インフルエンザウイルスと異なり孵化鶏卵を使ったウイルス産生がうまくいかない。したがって、細胞培養を使った不活性化ワクチンの作成か、別のアプローチが必要となる。
このため今回着目されたのが、mRNAワクチンだった。mRNAワクチンはユニークなアイデアだが、実用化には多くのブレイクスルーが必要とされた。
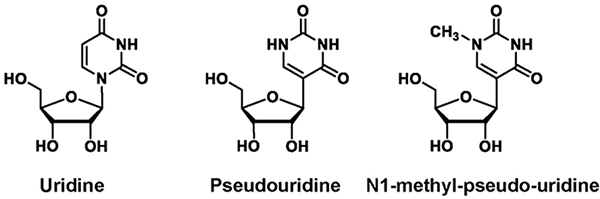
1つ目のブレイクスルーは、核酸修飾を受けたRNAは、TLRと反応しにくいという発見である。RNA修飾とタンパク産生について細かく解析すると、ウリジンをシュードウリジンに変更すればタンパク質を多く産生することができ、更に、1メチルシュードウリジンに変更すれば、元のRNAの数十倍ものタンパク質を作り出すことができる。このことは、少量のRNAでもタンパク質を効率よく細胞に作らせることが可能になったことを意味する。
更なるブレークスルーは、Cap構造である。従来法の改良により、in vitroで転写されたmRNAに100%Capがつき、翻訳効率は50%以上も向上することになった。またワクチンを作るにはmRNAを大量に産生し、Capをつける工程にも改良が必要だろう。今回のコロナ関連で多くの開発予算がつくことになり、これらの問題点が一気に解決できたのは、一番大きな進展であったかもしれない。
では、これをワクチンとして用いるというのは、どういうことなのか。mRNAを脂質ナノ粒子 (LNP) で包み、筋肉注射を行う。するとmRNAは筋肉細胞内に入り、細胞質で直ちにタンパク質が作られる。そのタンパク質は、細胞内の酵素でプロセッシングを受け、MHCクラスIに提示される。すると、細胞性免疫が活性化される。また、細胞に発現している完全な形のウイルスタンパク質は、異物である。細胞が死ねば、このタンパク質は抗原提示細胞へと輸送され、細胞内でプロセッシングされた後、MHCクラスIIに提示される。これは、やがて液性免疫の活性化へとつながる。
つまり、mRNAワクチンは擬似的なウイルス感染を体内で生じさせ、細胞性免疫、液性免疫の両方を活性化する技術なのだ。もちろん、全てのウイルスタンパク質が発現している生ワクチンと比べると免疫効果は弱いが、不活性化ワクチンよりはかなり強いことになる。さらに、変異ウイルスが出た場合も塩基配列を変えるだけだから、迅速な対応が可能となる。例えば、最近イギリスで発見された感染効率の高いウイルス株が、今のワクチンに効果がなくても 、すぐに対応可能だろう。では、今回開発が進んでいる2社のワクチンの詳細はどのようなものなのであろうか。
BioNTech社のワクチン (BNT162b2: Tozinameran) の場合、Cap1は改良型になっている。5’UTRはhuman alpha globin由来の配列である、この下流に新型コロナウイルスの感染に重要なSpikeタンパク質のシグナルペプチド、さらにコード領域を組み込んでいる。コード領域には、K986P、V987Pという2つの変異を挿入することで、中和抗体が産生されやすいようになっている。更に、3’UTRにはAmino-terminal enhancer of split (AES) という遺伝子に由来する配列と、ミトコンドリアの12Sリボゾームに由来する配列が挿入されており、これらの配列によりRNAの安定化と翻訳効率の増加が行われる。この後には、polyAが付加されている。もちろん、ウラシルは全て1メチルシュードウリジンに置換されている。このワクチンの保存は-80度となっている。全長は4,284塩基にもなる、長大なmRNAである9。
一方、Moderna 社のワクチン (mRNA-1273) の場合、詳しい情報がまだ出ていないのだが、論文によるとCap1の下流は全てSpikeタンパク質の配列で (K986P、V987Pは用いている)、ウラシルは全て1メチルシュードウリジンに置換されている10。おそらく製剤的な工夫がなされていると思われるが、このRNAがなぜ、-20度で保存可能になったのかは、詳細がわからない。
これらのワクチンに共通する問題は、3つある。
1つ目の問題は、温度管理である。多くのワクチンは、10度以下の冷蔵状態で保存されており、-20度や-80度で保存するワクチンは、長いワクチンの歴史の中で初めてではないだろうか。医療機関における温度管理が不十分だと、ワクチン効果は低くなることが予想される。
2つ目の問題は、アレルギーである。12月20日時点で、BioNTech社のワクチンは27万人に接種して6名の重症アレルギー (アナフィラキシー) が報告されている。頻度は、100万人あたり22名である。インフルエンザワクチンの場合、100万人あたり1.35人と言われている。この頻度はやや高い印象があるが、今回のワクチンはかなり厳密な監視下の元、投与が行われている。したがって、他のワクチンよりも発症頻度が高く出ているのかもしれない。両製品ともにLNPの構成成分にポリエチレングリコール (PEG) が含まれている。PEGは実験でよく使われるだけでなく、化粧品や歯磨き粉にも含まれており、多くの薬にも使われている試薬である。ところが、実はPEGアレルギーというのが存在する。このアレルギーは突然発症することが多く、その場合mRNAワクチン全般が投与できないことになる。
3つ目の問題は、自己免疫疾患である。ウイルス感染がほとんど生じない細胞にウイルスが感染した場合、ごくまれに自己免疫疾患が生じることがある。
従来の手法と比べ、mRNAワクチンは強力な感染予防効果が期待できる (両社のワクチンともに効果が90%以上と高いのはこのためである)。しかし、製品化されて時間がまだないので、まだ副作用の頻度が予想できないという欠点がある。ただし、アレルギーや自己免疫疾患の頻度はかなり稀であると予想される (投与したmRNAは最終的には分解されるため)。ファイザーのワクチンの場合、臨床治験に4万2千人もの人が参加し、更に米国では既に25万人が投与を受けたという。この中でいまだ自己免疫疾患の報告はない。まだわからない部分はあるが、それだけ期待されており、新型コロナどころかワクチンを革命的に変える可能性を秘めたワクチンなのだ。そしてこのワクチンの開発は、数十年にわたる基礎研究の積み重ねからできたというのも重要であろう。
インフルエンザワクチンが不活化ワクチンで、そのために液性免疫しか誘導できないために有効性が低く、mRNAワクチンは細胞免疫も誘導するので有効性が高いことはわかりました。あとは、何故DNAワクチンよりも有効性が高いのかを知りたいところです。
あと、「変異ウイルスが出た場合も塩基配列を変えるだけだから」と書かれていますが、この場合は臨床試験をやり直す必要がないことをどう示せるかが問題だと思います。


コメント