Neuropsin cleaves EphB2 in the amygdala to control anxiety
以下は、論文要約の抜粋です。
トラウマ(心的外傷)を引き起こすような出来事を経験した人々のうちの少数の者だけが不安障害を発症する。また、心理的なトラウマを経験した人数と不安障害の発症する人数の間に相関が見られないことの理由は不明である。
細胞外でのタンパク質分解は、ニューロンと細胞外マトリクスの接点における神経可塑性を促進させることで、恐怖に関連した応答に関与している。
本論文では、マウスにおいては、セリンプロテアーゼのニューロプシンが、EphBとNMDA受容体の相互作用、Fkbp5の発現、そして不安様行動の3つを制御することにより、扁桃体のストレスに関連した神経可塑性に極めて重要であることを示す。
ストレスは、扁桃体において、ニューロプシンによるEphB2の(細胞外部分)切断を引き起こし、EphB2がNMDA受容体NR1サブユニットから解離して、EphB2受容体の膜での代謝回転が促進される。その結果、EphB2–NR1の相互作用がNMDA受容体電流を増強し、Fkbp5の遺伝子発現が誘導されて、不安の行動指標が強まる。
ストレス下においても、ニューロプシン欠損マウスは、EphB2の切断とNR1からの解離が起こらないためにFkbp5遺伝子の発現は低く不安も弱い。ストレスに対する行動反応は、ニューロプシン欠損マウスの扁桃体内にニューロプシンを注入すると回復し、野生マウスの扁桃体への抗EphB2抗体注入、あるいはFkbp5遺伝子のサイレンシングによって阻害される。
我々の結果は、扁桃体においてストレスが引き起こすEphB2のタンパク質分解を不安に結びつける新規神経経路を確立するものである。
EphB2は、受容体型チロシンキナーゼで、ニューロンのNMDA型グルタミン酸受容体の機能を調節することが知られています。また、アミロイドβオリゴマーが、EphB2のフィブロネクチンリピート様ドメインに結合し、プロテアソームでのEphB2の分解を引き起こし、記憶形成に重要な、NMDA受容体電流の低下と歯状回の長期増強の障害を起こすことも知られています(論文をみる、下図参照)。これらの結果から、EphB2のレベルや機能を高めることはアルツハイマー病に有益な可能性があると考えられています。またEphB2は、この論文で扱われている扁桃体や記憶の中枢である海馬に高度に発現していることが知られています。
一方、ニューロプシンは奈良先端大の塩坂さんらによって発見されたセリンプロテアーゼで、海馬・扁桃体に高度に発現し、長期増強などの神経可塑性への関与が示唆されています(レビューをみる)。
本論文では、EphB2とニューロプシンとが扁桃体に共局在し、EphB2はニューロプシンによって特異的に切断されることなど、ニューロプシンがEphB2を介してNMDA受容体や不安行動を制御することを明らかにしました。
研究者らは、不安ストレスが副腎皮質ステロイドを介する経路と、本論文のニューロプシンを介する経路の2つの経路が、恐怖関連遺伝子Fkbp5の発現を制御するモデルを提唱しています。問題は、EphB2もNMDA受容体も、不安だけに関連するわけではないので、簡単には不安障害の治療標的にならないと思われることです。
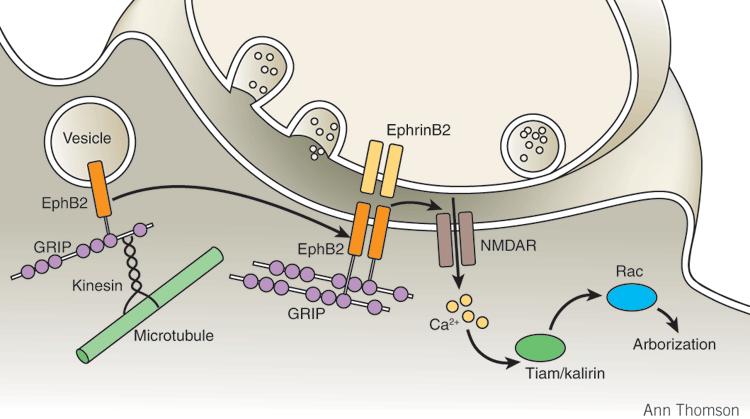
EphrinB2、EphB2、NMDA受容体の関係(nature neuroscienceより)



コメント