Mutations in GNA11 in Uveal Melanoma
以下は、論文要約の抜粋です。
背景:ぶどう膜メラノーマは、眼内腫瘍の中で最も頻度が高く、転移性腫瘍に対する有効な治療はない。ぶどう膜メラノーマの約40%で、ヘテロ三量体G蛋白質αサブユニットをコードする遺伝子GNAQの変異が認められる。
方法:各種のぶどう膜メラニン細胞性新生物713例(ぶどう膜メラノーマ186、青色母斑139、その他の母斑106、その他の黒色腫282)において、GNAQとGNAQのパラログであるGNA11の第5エクソンの配列を決定した。これらの中453例について、GNAQとGNA11の第4エクソンの配列を決定し、ぶどう膜メラノーマ97例と青色母斑45例について、GNAQとGNA11の全エクソンの配列を決定した。
結果:GNA11とGNAQ の両方で、かつ相互排他的に、第5エクソン(Q209)と第4エクソン(R183)の体細胞変異が認められた。GNA11のQ209変異は、青色母斑の7%、原発性ぶどう膜メラノーマの32%、転移性ぶどう膜メラノーマの57%で認められた。一方、GNAQのQ209変異は、青色母斑の55%、ぶどう膜メラノーマの45%、転移性ぶどう膜メラノーマの22%で認められた。R183変異は、GNAQ、GNA11のどちらでもQ209変異と比べて少なかった(青色母斑の2%、ぶどう膜メラノーマの6%)。GNA11の変異は、マウスモデルで自発的転移腫瘍を誘発し、マップキナーゼ経路を活性化した。
結論:今回解析したぶどう膜メラノーマの83%で、GNAQあるいはGNA11の体細胞変異が認められた。これら2つの遺伝子が関与する経路の構成的的活性化は、ぶどう膜メラノーマの発症の主な要因だと考えられる。
メラノーマの治療は現在劇的に変化しています。BRAFの変異が最初に発見されたわずか8年後に、特異的阻害薬PLX4032が登場しました。皮膚由来のメラノーマの場合、その約半分にBRAF変異があり、PLX4032が有効だとされています(関連記事)。
しかし、PLX4032は、ぶどう膜メラノーマに対して無効でした。ぶどう膜とは、虹彩と毛様体、脈絡膜の総称のことです。ぶどう膜メラノーマとは、このぶどう膜内のメラニン細胞が、がん化したものです。
日本での年間発症率は、1,000万人に対して2.5人。白人の発生頻度は高く、1,000万人あたり43人ほどで、日本のおよそ17倍の発症が報告されています。(国立がん研究センターより)
同じメラニン産生細胞から発生したメラノーマ(悪性黒色腫)ですが、皮膚のメラノーマとブドウ膜のメラノーマで、がん化の原因遺伝子がまったく異なることに驚きました。さらに、80%以上にほぼ同じ変異があるというのにも驚きました。
また、同じ変異があっても青色母斑、ぶどう膜メラノーマ、転移性ぶどう膜メラノーマと3種類の異なる性質の腫瘍になるということは、G蛋白質以外の要因が関係することを意味しています。これらの細胞のゲノムを解析すれば、良性・悪性・転移性などの要因が明らかになるかもしれません。
ヘテロ三量体G蛋白質の変異によるがん化は、卵巣がんの12%、HER2ネガティプの乳がんの20%、ホルモン受容体ポジティブの乳がんの13%に認められるそうです。本論文でも、変異したGNA11を導入するとマップキナーゼ経路が活性化することが示されていますが、G蛋白質とマップキナーゼをつなぐ経路は不明です。
変異G蛋白質に直接働く、あるいはマップキナーゼ経路へのインプットを阻害するような薬物の登場が待たれます。
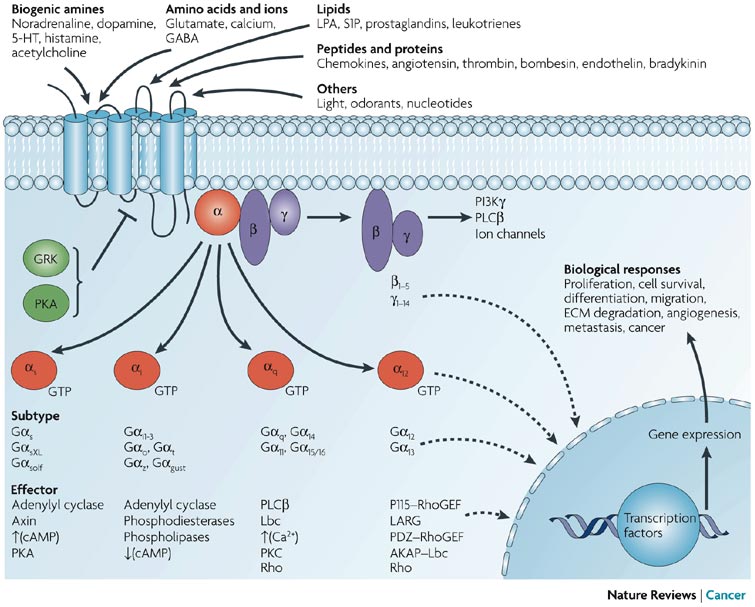
ヘテロ三量体G蛋白質(Nature Reviewsより)

関連記事
BRAF変異メラノーマでのRAF阻害薬はシグナル経路を80%以上阻害しないと臨床的に有効ではない
転移性メラノーマの変異により活性化したBRAFの阻害

コメント