試験薬入手困難で脳梗塞の臨床試験が存続の危機に…国立循環器病研究センターがクラウドファンディング開始
以下は、記事の抜粋です。
国内で進行している、急性期脳梗塞に対する新規治療薬テネクテプラーゼの多施設共同医師主導試験(T-FLAVOR)の存続が危ぶまれている。テネクテプラーゼの薬剤価格が約30万円から160万円に急上昇しているだけでなく、2022年夏頃から同薬の世界的な需給逼迫が続いていることなどが理由。このため、日本医療研究開発機構(AMED)の助成金のみで試験薬を購入し続けることが難しくなっている。同試験を主導する国立循環器病研究センター脳卒中集中治療科特任部長の井上学氏らが4月12日、会見を開いた。同日よりクラウドファンディングを立ち上げ、試験薬購入のための資金を募っている。
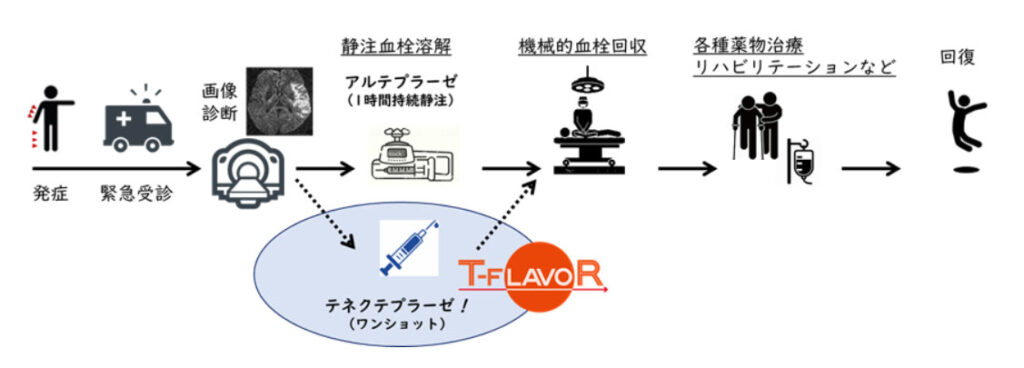
ワンショットで従来薬より高い効果と安全性
テネクテプラーゼは、現在、国内で急性脳梗塞の血栓溶解療法として唯一承認されているアルテプラーゼを改良した新規薬剤。「高いフィブリン親和性を有し、出血合併症を抑えることができる他、半減期が長いため、アルテプラーゼの投与時間(1時間)に対し、ワンショット静注で投与が完了する。血管再開通率が2.2倍優れ、安全性が高いことが確認されている(N Engl J Med. 2018; 378: 1573-1582.)」(井上氏)。
テネクテプラーゼの国内開発は行われていないことから、井上氏らは、2021年からAMEDの助成を受け、国内14施設が参加するT-FLAVORを開始している(図)。
各国の脳卒中ガイドラインで適応外使用を推奨
テネクテプラーゼは欧米で既に急性心筋梗塞の血栓溶解療法の適応を獲得している(日本未承認)。井上氏によると、2020年以降、欧米で急性期脳梗塞への使用が急増し、需給が逼迫している。さらに新型コロナウイルス感染症流行、円安、ウクライナ危機による世界的な輸送費の高騰で、薬剤価格が約30万円から160万円に急上昇したことが追い打ちを掛けた。
需給逼迫の背景には、「オーストラリアや米国、欧州などの脳卒中ガイドラインにおいて、急性期脳梗塞に対するテネクテプラーゼが相次いで推奨され、同薬の使用が世界的潮流となったことも関連している」と井上氏。メーカーは増産体制の構築に着手しているものの、需給逼迫の解消には約3年かかる見通しを示している。
「アルテプラーゼが製造中止の可能性も」
急性期脳梗塞に対し、国内で承認されている血栓溶解薬はアルテプラーゼのみ。テネクテプラーゼはアルテプラーゼと同じ企業が製造・販売(ジェネンテック、べーリンガー・インゲルハイム)していることから、テネクテプラーゼの世界的な需要の高まりが続けば、「市場原理から、アルテプラーゼの製造を縮小していくことも推測される。そうなると、日本で今まで行ってきたアルテプラーゼによる標準的な血栓溶解療法が行えなくなる可能性が高まる。関連学会のメンバーもその点を非常に懸念している」と井上氏。「なんとしてもT-FLAVOR試験を完遂させる必要がある」と強調する。
1000万円で5本、1500万円で7本の購入が可能に
今回のクラウドファンディングでは試験薬の購入のための資金を募集する。井上氏は、「1000万円でテネクテプラーゼが約5本分購入できる。第2段階の募集金額(1500万円)では7本分の購入が可能になる。いただいたご寄付は全てテネクテプラーゼの購入に充てる」と説明。「クラウドファンディングが成功すれば、T-FLAVOR試験完遂の可能性が高まる。日本のドラッグラグを回避し、日本の患者さんがより安全で効果の高い世界標準の治療を受けることができる」と呼びかけている。
既に欧米で承認されている薬について、もう一度日本で臨床試験をして有効性を示さないと承認しないというこのような日本の仕組みは、国内のメーカーが時間稼ぎをして、2番せんじの薬を出すためのものでした。これによって、日本の製薬会社は国際競争から守られてきました。それだけが原因ではないと思いますが、車と違って日本の製薬会社の開発力は世界から大きく遅れています。
このような悪習は、一時的には日本のメーカーを守るかもしれませんが、長期的には会社の研究開発力を衰えさせ、何よりも新薬を使えば助かったのはずの何人かの患者の命を奪います。おかしな話です。


コメント