以下は、論文要約の抜粋です。
ヒスタミン生成を担う唯一の酵素であるHistidine decarboxylase (HDC)は、骨髄細胞に高度に発現しているが、これらの細胞おけるHDCの機能は良くわかっていない。本論文で、 Hdcノックアウトマウスは結腸と皮膚での発がんが高率であることを示す。
EGFPレポーターをHdcプロモーター下流につないだ構築を遺伝子導入されたマウスを使って、Hdcは化学発がんの早期にリクルートされるCD11b+Ly6G+の未成熟骨髄細胞(IMCs)に主に発現していることがわかった。
Hdcノックアウトマウスの骨髄を野生型レシピエントマウスに移植すると、CD11b+Ly6G+細胞の動員が増加し、ノックアウトマウスのがん感受性表現型が再現される。さらに、HdcノックアウトマウスのIMCsは同種移植した腫瘍片の増殖を促進するが、マウスCT26結腸がん細胞は、Hdcプロモーターの過剰メチル化を介してHdc発現を低下させ、骨髄細胞の成熟を阻害する。
ヒスタミン投与はIMCsの分化を誘導し、IMCsが腫瘍同種移植片増殖をサポートする能力を抑制する。これらのデータは、Hdcとヒスタミンが骨髄細胞の分化において、CD11b+Ly6G+ IMCsが早期がん発生において、それぞれ重要な役割を果たしていることを示している。
Histidine decarboxylase (HDC)は、渡邉建彦東北大名誉教授が阪大時代からライフワークとして研究されていた酵素です。本論文でも彼のグループによるHdcノックアウトマウスの論文が引用されています。
HDCノックアウトマウスで化学発癌が増加するというわかりやすい話です。アトピーの患者はがんになりにくいという報告もあるそうですので、ヒスタミンが発がんを抑制するというのは間違いなさそうですが、メカニズムについてはまだ不明な点が多く残っています。
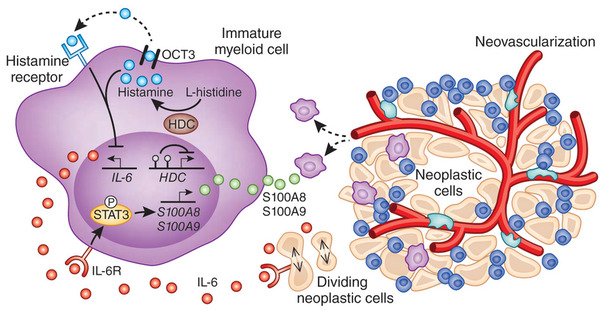
研究者らは、ヒスタミンがIL6の発現を抑制し、ヒスタミンの減少はIL6/STAT3経路を刺激してがんを発生させるという仮説(下図参照)を提唱しています。しかし、トゥレット症候群(Tourette’s Syndrome)においてHDCの変異が報告されており(論文をみる)、本症候群で発がんの増加が報告されていないことを考えると、ヒトでまったく同じことがおこるかどうかはまだわかりません。
炎症関連発がんにおけるIMCsによるHDC産生の役割(Nature medicineより)



コメント