Unresponsiveness of colon cancer to BRAF(V600E) inhibition through feedback activation of EGFR
以下は、論文要約の抜粋です。
PLX4032(ベムラフェニブ)によるBRAF(V600E)がんタンパク質の阻害は、メラノーマ治療にきわめて有効性である。しかし、同じ BRAF(V600E)発がん性変異を持つ結腸がん患者は予後不良で、PLX4032に対してほとんど反応しない。
本論文では、 この原因を調べるために、ヒト細胞でRNA干渉法に基づく遺伝学的スクリーニングを行い、ノックダウンするとBRAF(V600E)阻害と相乗的な効果を示すキナーゼを探索した。
上皮増殖因子受容体(EGFR)の阻害が、BRAF(V600E)阻害と強い相乗効果を示すことを報告する。BRAF(V600E)変異を持つ多くの結腸がんで、抗体薬のセツキシマブ、低分子薬のゲフィチニブあるいはエルロチニブによりEGFRを阻害すると、in vitroとin vivoの両方で、BRAF(V600E)阻害に対して強力な相乗作用が見られた。
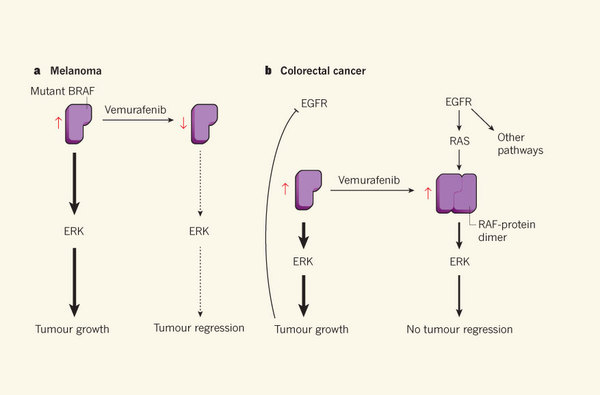
このメカニズムとして、BRAF(V600E)阻害がEGFRの急速なフィードバック活性化を引き起こし、それがBRAF(V600E)阻害剤の存在下での継続的な細胞増殖を維持させることがわかった。メラノーマ細胞はEGFRの発現が低いため、このフィードバック活性化を受けない。
黒色腫細胞にEGFRを異所的に発現させるとPLX4032耐性を生じることはこの仮説と一致している。BRAF(V600E)変異を持つ結腸がん(全結腸がんの約8–10%)は現在、分子標的治療の選択肢がないが、BRAFおよびEGFRの阻害剤の併用療法が有効かもしれない。
メラノーマの40から60%において、BRAFというマップキナーゼ・キナーゼ・キナーゼに変異があります。また、BRAF変異の90%は、600番目のアミノ酸であるバリン(V)がグルタミン酸(E)に変化しています(V600E変異とよぶ)。この変異によって、下流のマップ・キナーゼ経路が常に活性化された状態になり、細胞増殖が止まらなくなります。
ベムラフェニブ(Vemurafenib/PLX4032/RO5185426)は、このBRAF(V600E)活性を阻害し、この変異を有する転移性メラノーマ患者に用いたところ、大部分の患者で腫瘍の完全あるいは部分的退縮が認められました。これらの結果を受けてFDAは昨年の8月にベムラフェニブを承認しました。日本はまだです。
しかし、同じように活性型BRAF(V600E)変異を有する結腸がんは一般に、ベムラフェニブに反応しないそうです。研究者らは、この不応答性がBRAF阻害によって上皮増殖因子受容体(EGFR)がフィードバック活性化を受けるためであることを明らかにしました。下図のように、結腸がんではBRAFがEGFRをフィードバック阻害しており、BRAFを阻害するとこれがなくなるためにEGFRが活性化されてしまうというのです。
以前に紹介したHRAS Q61Lなどの変異を持つ患者にベムラフェニブを投与すると、HRASとCRASがダイマーを作るなどのメカニズムによって、逆説的にマップキナーゼ経路が活性化されるという話とよく似ています(記事をみる)。
BRAFの下流のERKがCDC25をリン酸化して活性化し、これがEGFRを脱リン酸化して抑制するフィードバック阻害を考えているようですが、証明はされていません。メカニズムはさておき、BRAF阻害薬とEGFR阻害薬の併用で大腸がんの約1割が治療できるなら素晴らしい話だと思います。臨床試験に期待したいと思います。
BRAF阻害がEGFRを活性化するメカニズム(Natureより)

関連記事
BRAF阻害薬により治療された患者に発生した皮膚扁平上皮がんにおけるRAS 変異
米国FDAがベムラフェニブ(Vemurafenib、PLX4032、ゼルボラフ®)を承認


コメント