p53は、多くのがんで不活性化されており、その機能回復ががん治療に結びつくと考えられていました。この考えが”yes and no”であることが、Natureの11月25日号に掲載された2つの論文によって示されました。以下は、論文要約の抜粋です。
Selective activation of p53-mediated tumour suppression in high-grade tumours
非小細胞肺がん(NSCLC)は、がん死亡の主要原因で、その5年生存率は10~15%である。NSCLCでのRas経路異常は、Krasを活性化する変異を通じて起こることが多い。また、NSCLCでは多くの場合、p53が不活性化されている。したがって、p53機能の薬理学的回復はNSCLCの治療戦略の1つとして有望だと考えられている。
本論文では、p53機能回復によってどのような治療効果がみられる可能性があるかを、内因性Krasがん遺伝子の発がん的活性化により誘導されるNSCLCマウスモデルを用いて調べた。意外にも、p53の機能回復によって腫瘍の顕著な縮小は誘導されなかったが、悪性度の高い腫瘍の相対的割合を相当度低下させた。
これは、各腫瘍内で悪性度のより高い腫瘍細胞でのみ、p53が選択的に活性化されるためである。p53のこのような選択的活性化は、Ras/MAPKシグナル伝達活性および、p19ARFの誘導と相関している。
以上の結果は、Rasシグナル伝達量がある閾値以上の場合にだけp53を介する腫瘍抑制作用が発揮されることを示している。腫瘍の初期進展を抑制するp53の能力や、p53の機能回復によるがんの消退効果には限界があるということが重要である。
Stage-specific sensitivity to p53 restoration during lung cancer progression
腫瘍形成は多段階的な過程であり、がん遺伝子やがん抑制性遺伝子の経路で時間とともに変異が蓄積することにより起こる。p53がん抑制遺伝子経路の変異はヒトがんではよく認められ、この障害を薬剤によって再活性化する研究が盛んである。
本研究では、マウスの肺腫瘍でp53の機能を回復させると、悪性腺がんでは、有意だが不完全な腫瘍細胞喪失がみられるが、肺腺腫ではみられないことを示す。
また、MAPKシグナル伝達の増強が、悪性化の重要な決定因子であると同時に、Arfがん抑制遺伝子発現の刺激因子でもあることを示す。p53機能回復に対するがんの応答は、Arfの発現に強く依存している。
これらの結果は、p53の機能回復は、がん遺伝子シグナル伝達が増大している場合には腫瘍退縮をひきおこすが、初期段階の肺腫瘍発生時の低いがん遺伝子活性では、p53経路は働かないことを示している。さらに、機能回復してもがん細胞集団のステージが不均一であるために、がんの退縮が不完全なものになる可能性があることを示唆している。
2つの論文は、アポトーシスの有無が違うぐらいでほとんど同じ結果です。
ArfはRas/MAPKの下流で活性化され、Arfはp53の活性化因子ですので、MAPKシグナル伝達が増強された悪性度の高いがんでp53機能回復の効果が強いというのはリーズナブルですが、機能回復しても悪性度の低いものを見逃してしまうところがおもしろいと思いました。p53は細胞をがん化から守る守護神だといわれていますが、少し脇が甘いようです。
これまでの研究では、がんのモデルとして悪性度の高いものばかりが使われていたため、p53の機能回復が強いがん抑制効果を示す報告ばかりだったようです。今回の2つの研究グループは、ヒトで発症するがんに良く似た非小細胞肺がん(NSCLC)のマウスモデルを使ったために、このような”yes and no”の結果が得られたと思われます。
まとめると、がんを退縮させるためには、p53の機能を回復するだけでは不十分で、同時にArfを活性化する必要があるようです。この課題を薬理学的に解決するのはけっこう難しいと思います。製薬業界はどのように対応するのでしょうか?
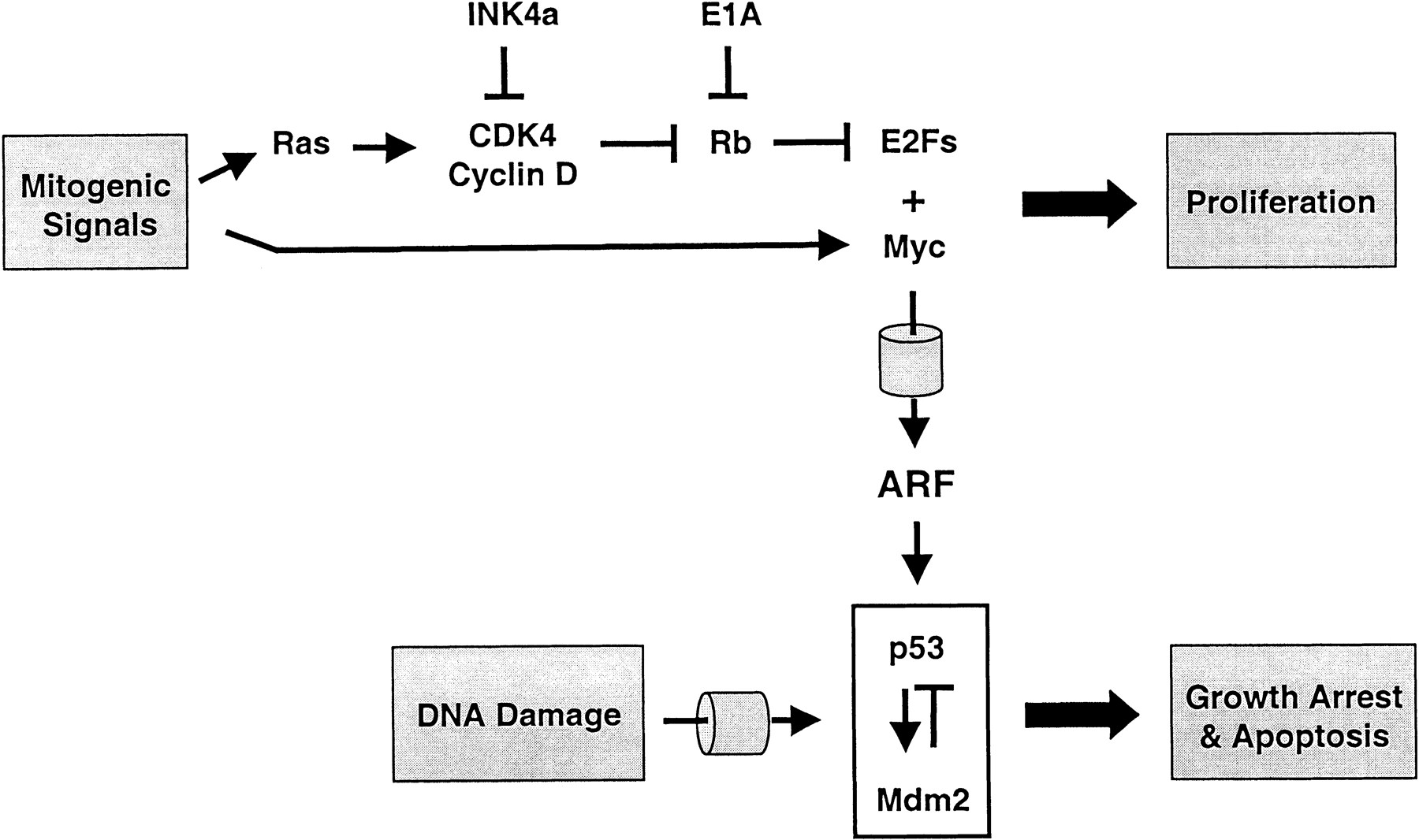
またp53は、増殖シグナルやArfだけではなく、DNA損傷によって活性化されることが良く知られています(下図参照)。しかし、これら2つの論文の結果では、DNA損傷によるp53の活性化はほとんど抗腫瘍作用に関与していないように思われます。このあたりの疑問も今後の課題として残っています。
p53の制御機構(Genes & Developmentより)



コメント