エーザイ、アルツハイマー病新薬「有効性確認できた」…来年中の承認目指す
以下は、記事の抜粋です。
エーザイは9月28日、開発中のアルツハイマー病の治療薬「レカネマブ」について、最終段階の臨床試験で「症状悪化を抑える有効性が確認できた」と発表した。同社は2023年3月までに日本、米国、欧州で承認申請し、同年中の承認を目指す。
アルツハイマー病では、脳内に異常なたんぱく質「アミロイド βベータ (Aβ)」が蓄積すると言われている。レカネマブは脳内のAβを取り除いて神経細胞が壊れるのを防ぎ、早期のアルツハイマー病患者や軽度認知障害(MCI)の人を対象に病気の進行を抑制することを目指す。米製薬企業バイオジェンと共同開発している。
治験は国内外の約1800人を対象に、1年半にわたって2週間に1回レカネマブを注射した集団と偽薬を注射した集団に分けて実施した。記憶力や判断力など認知症の重症度を示す指標(最も重い=18点)について変化を比較した。
その結果、偽薬のグループでは1.67点悪化したが、レカネマブでは1.22点にとどまったため、「27%の進行抑制効果が確認された」としている。安全性については「大きな問題はない」とした。エーザイは、論文をまとめ、11月に学会で詳細なデータを公表する。米国では迅速承認の申請を既に行っており、来年1月に暫定的に使用が認められる可能性がある。
アルツハイマー病の治療薬を巡っては、米食品医薬品局(FDA)が21年、両社が開発した「アデュカヌマブ」を条件付きで承認した。しかし、国内では同年12月、「症状の進行抑制効果の証明が不十分」として承認が見送られていた。
岐阜大脳神経内科の下畑 享良 教授は「Aを取り除くことによって、認知機能の低下を抑制できることを示せた意義は大きい。ただ、認知機能を回復させる薬ではないため、本人や家族が効果を実感することは難しいかもしれない。対象となる早期患者を判断する検査体制や、高額になる医療費なども今後の課題となる」と話す。
以下は、標題のニュースについて読売新聞にコメントした下畑氏が、「私の意見はコンパクトなものになるようですが,脳神経内科医として大きな関心があり,じつはいろいろ個人的な感想を述べました.以下,まとめておきます.」としてFacebookに投稿した記事です。
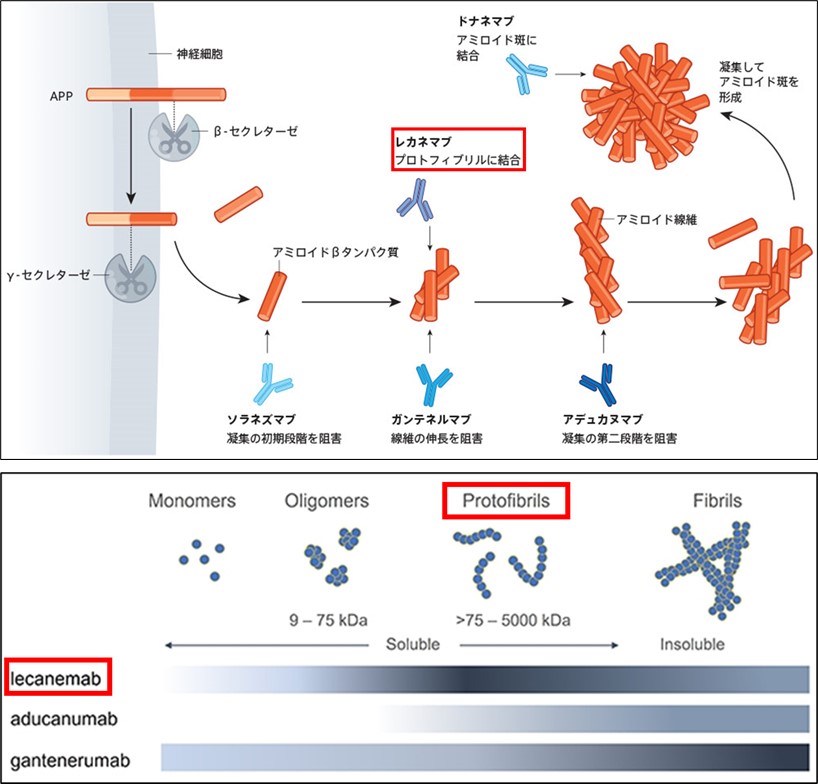
アミロイドβの単量体が2個以上結合して低分子オリゴマーとなり,さらに多くが集まってプロトフィブリルといった高分子オリゴマー化する.凝集が進むと最後は線維状となり,それを成分とする老人斑が形成される.レカネマブは凝集の早期の段階のプロトフィブリルを認識する.
この臨床試験を要約すると,大規模グローバル臨床第Ⅲ相Clarity AD検証試験で,開始18カ月の時点での全般臨床症状の評価指標であるCDR-SB(Clinical Dementia Rating Sum of Boxes)スコアの平均変化量は,レカネマブ群が偽薬群と比較して-0.45となり,27%の悪化抑制を示し(p=0.00005),主要評価項目を達成したというものになります.詳細はプレスリリースに記載があります(
https://www.eisai.co.jp/news/2022/news202271.html).以下,感想です.
◆感想① とても大きな効果とまでは言えないが,27%抑制できたことは大きな進歩である.加えて今後の研究における意義は極めて大きい.
理由1.認知機能低下の進行抑制を示せた点で意義が大きい.
先行薬のアデュカヌマブは,認知機能の低下を遅らせるという効果ではなく,アミロイドβを除去するという効果に基づいて承認されたため議論や批判が生じたが,今回のレカネマブは認知機能の低下の進行抑制を示せた点で大きな違いがある.
理由2.揺らぎつつあったアミロイドβ仮説への疑念を払拭する意義は大きい.
アミロイドβ凝集のより早期の段階(プロトフィブリル;図)を標的とすることが有効である可能性が初めて実証された.今後,この仮説に基づく研究がさらに推進され,より効果の高い新薬が開発される可能性がある.
理由3.懸念とされた副作用が少なかったことを示せた意義は大きい.
症候性のARIA-E(浮腫) の発現率はレカネマブ群で2.8%,偽薬群で0.0%.症候性ARIA-H (出血)の発現率はそれぞれ0.7%と0.2%.つまり副作用がないわけではなく適切な評価・対応が求められるが,この頻度は個人的には許容範囲と考える.
◆感想② ただし複数の重大な問題点が残されていることを認識する必要がある.
理由1.進行を抑制する病態抑止薬であり,本人や家族が効果を実感できるかが重要である.
本剤は偽薬群と比較して進行の程度が抑制されることが示された.しかし本人がその効果を対照群と比較して実感できるわけではない.27%抑制されているとはいえ,病状は進行するわけで,本人が薬剤の効果を実感すること,家族が介護負担の軽減を実感することは難しいかもしれない.
理由2.誰でも使用できる薬剤ではないことに注意が必要である.
a) より正確な診断がなされる必要がある・・・診断を誤れば当然効かない.専門医による診察,脳脊髄液検査やアミロイドPET等が必要.
b) 通院できる病院が限定される・・・正確な診断のみならず,副作用が生じたときに頭部MRIによる評価ができ,救急対応できる病院での治療に限られるだろう.
c) より早期の患者に使用される・・・軽度認知障害(MCI)~軽症認知症期の,早期のアルツハイマー病患者を対象とした臨床試験である.進行例ではおそらく無効である.またMCIや物忘れを心配する人が多数病院を受診するという状況も初めて経験することになる.何が起こるのか想像がつかない.本剤の適応症(効能・効果)をどうするかはきわめて大きな問題となる.
理由3. より長期の効果に関する情報が必要である.
効果判定を行った1年半という期間は,MCIや軽症認知症患者にとっては短い期間である(療養期間は長い).つまり長期的な効果が示されていない薬剤と言える.
理由4.医療経済学的・倫理的問題が未解決である.
米国ではどの程度の患者に使用されるかは加入保険(支払機関)の制限が大きい.これに対し,日本では医薬品が承認されれば基本的に保険収載される.つまり通常の保険診療で使えるため対象となる患者がかなり多数となる.MCIのみでも有病者数約400万人と推計されている(平成24年).アデュカヌマブの米国での薬価は当初,年間5万6000ドル=800万円超と設定されたが,単純計算すると32兆円となる.医療費削減が課題である日本にありえない金額である.つまりどのような人に使用するかという議論が生じ,医学的・倫理的な解決が求められる.
また改めてこの薬剤が本当にそのコストに見合うかという根拠が求められるだろう.「27%抑制」は全員が一律に27%抑制されるわけではなく,効果の強い人もいれば,効果のない人もいる.個人的には治療効果に応じて薬剤価格が変動する支払償還方式(Value-Based Pricing)を導入すべきと考えている.ただし効果の判定は短くても半年とか1年という時間を要する,難しいものになるだろう.
フェアなコメントですが、こんなにたくさんコメントしてもほんのちょっとしか掲載されないとは、、、



コメント