バイオジェンとエーザイの認知症薬、FDA諮問委の支持得られず
以下は、記事の抜粋です。
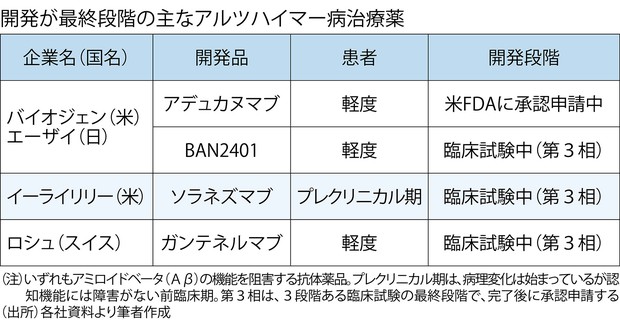
米バイオジェンとエーザイが共同開発したアルツハイマー病治療薬アデュカヌマブに対し、米食品医薬品局(FDA)の諮問委員会は11月6日、前向きな評価を与えなかった。FDAによる同薬品承認の是非は不透明になった。
委員会では前向きな結果を出した一つの治験データを相反する内容の別データと対比して検証した結果、有効性を十分に証明できなかったとの見解に8票、証明できたとの見解に1票、判断保留に2票が投じられた。委員会の会合前にFDAスタッフがまとめた報告書は、有効性を示唆する内容となっていた。
6日の米株式市場でバイオジェン株は売買停止となった。4日には44%急伸し、5日に7.5%反落した。
アデュカヌマブ(aducanumab)については、関連記事のようにこれまでもこのブログで何度も取り上げてきました。第Ⅲ相の臨床試験が成功したというニュースを疑いながらも大規模解析(臨床第Ⅲ相試験であるEMERGE試験)で認知機能の悪化を有意に抑制し、アミロイドプラークの沈着も減少させたという報告をみて、「本当に効果がある可能性はあります」と書きましたが、取り消します。やはりアミロイドβを標的としたアルツハイマー病治療薬の開発は難しいようです。
関連記事
エーザイのアルツハイマー病治療薬候補アデュカヌマブ(aducanumab)の臨床第III相試験が成功、承認申請へ。
エーザイとバイオジェンが承認申請中の「認知症薬」は「根治薬」ではない。
アルツハイマー型認知症(AD)治療薬「アデュカヌマブ」についての2つの記事
また失敗したBACE1阻害薬:アミロイドβはアルツハイマー病治療薬の標的になるのか?


コメント