肥大型心筋症治療のパラダイムシフト
以下は、記事の抜粋です。自分用のメモです。
Key Point
●肥大型心筋症(HCM)の病態理解は、サルコメア蛋白遺伝子異常による「心筋の過収縮とエネルギー非効率性」を根源とする疾患へと深化している
●診断には心エコーやMRI、遺伝子検査が有用で、AI解析も注目されている
●サルコメアを直接制御する初の病態修飾薬、心筋ミオシン阻害薬を深掘り
はじめに
肥大型心筋症(hypertrophic cardiomyopathy:HCM)は、高血圧症や弁膜症などほかの心疾患では説明できない“左室ないし右室心筋の肥厚を呈する最も頻度の高い遺伝性心疾患”である。
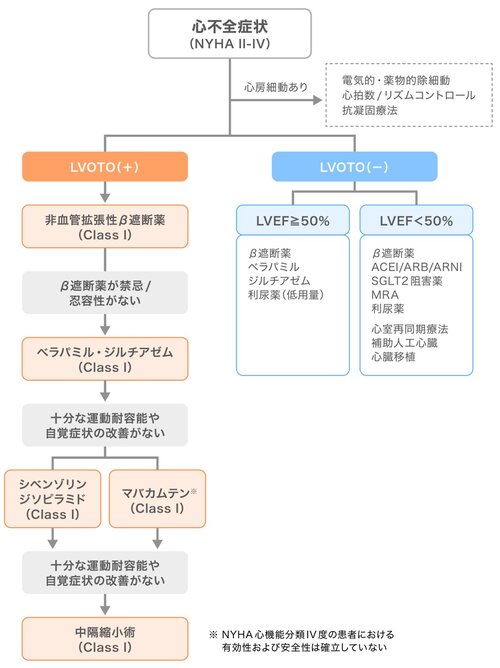
左室流出路閉塞(LVOTO)の有無、心不全症状、致死性不整脈リスクなど、その臨床像は極めて多様性に富む。これまでの治療は対症療法が中心であったが、近年、疾患の根源的病態であるサルコメアの機能異常に直接作用する心筋ミオシン阻害薬(Cardiac Myosin Inhibitor:CMI)が登場し、治療は大きな転換期を迎えている。
最新治療を理解するための病態生理
HCMの病態理解は、単なる「心筋の肥厚」から「サルコメアの機能異常」へと深化している。HCMの多くは、心筋収縮の基本単位であるサルコメアを構成する蛋白(βミオシン重鎖、ミオシン結合蛋白Cなど)の遺伝子変異に起因する。
これらの変異は、心筋ミオシンのATPase活性を亢進させ、アクチンとミオシンが過剰に架橋を形成する「心筋の過収縮」状態を引き起こす。この過収縮はATPの過剰消費を招き、心筋のエネルギー効率を著しく低下させる。結果として、心筋は相対的なエネルギー欠乏と弛緩障害に陥り、心筋虚血、線維化、そして代償的な心筋肥厚が進行する。
最新の診断方法
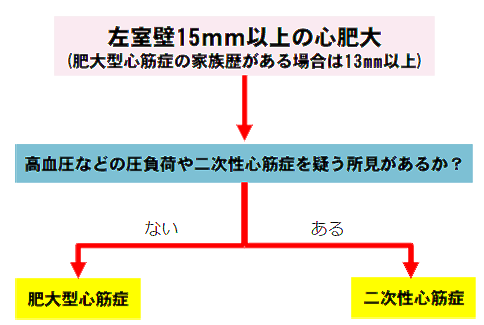
画像診断:心エコー図検査が基本であり、15mm以上の最大左室壁厚(家族歴があれば13mm以上)が診断の契機となる。LVOTO(安静時・バルサルバ法や運動など生理的誘発時圧較差)、僧帽弁収縮期前方運動(systolic anterior movement:SAM)、拡張機能、左房容積などの評価が必須である。心臓MRI(CMR)は、心エコーで評価困難な心尖部等の形態評価に加え、ガドリニウム遅延造影(LGE)による心筋線維化の検出・定量評価に優れる。LGEの存在とその広がりは突然死リスクの重要な修飾因子であり、リスク層別化に不可欠である。
バイオマーカー:最新のガイドラインでは、BNP/NT-proBNPが全死亡予測や治療モニタリングに有用(推奨クラスIIa)、高感度トロポニンも予後の推測に有用(推奨クラスIIa)とされている。
遺伝学的検査:2022年に保険収載され、その重要性は増している。原因遺伝子の同定による確定診断、血縁者に対するカスケードスクリーニング(発症前診断)、そして予後予測への応用が期待される。
AI技術の応用:人工知能(AI)は、HCM診断の各側面でその応用が進んでいる。たとえば心電図解析では、AIが人間の目では捉えきれない微細な波形パターンからHCMを極めて高い精度で検出し、専門医が「正常」と判断した心電図からでもHCMを見つけ出す可能性が指摘されている。
心筋ミオシン阻害薬
心筋ミオシン阻害薬(Cardiac Myosin Inhibitor:CMI)は、心筋収縮の中心的役割を担うサルコメアを標的とした新規治療薬として注目されている。代表的な薬剤には、初の経口選択的CMIであるマバカムテン(商品名:カムザイオス)および次世代CMIとして米国で承認審査中のaficamtenがある。CMIは心筋ミオシン重鎖のATPase活性を抑制し、アクチン-ミオシン間の架橋形成を減少させることで濃度依存的に心筋収縮力を低下させる。これにより、心筋過収縮状態のエネルギー効率を改善し、拡張機能の正常化が期待される。
HCMを対象としたRCTでは、CMIが左室流出路圧較差の有意な改善、NT-proBNPの低下、運動耐容能(peak VO2)や症状(NYHAクラス)の改善など、多面的な臨床効果を示している。また近年では、CMI治療中の病態変化を非侵襲的かつ連続的に評価する手法として、AI技術を応用した心電図解析(AI-ECG)の有用性が報告されている。
なお、マバカムテンの使用にあたっては本連載(第2回)でも触れた通り、 日本循環器学会(JCS)からはマバカムテンの適正使用に関するステートメントも発表されており、その導入には厳格な管理体制が求められる。
この記事をみるまで私は、単なる「心筋の肥厚」だと思っていました。「サルコメアの機能異常」も「心筋ミオシン阻害薬」も「マバカムテン(商品名:カムザイオス)」も初耳です。


コメント