以下は、記事の抜粋です。
インフルエンザウイルスが感染力を保ったまま治療薬タミフルに対する耐性を持つ仕組みを解明したと、カリフォルニア工科大の研究チームが6月4日付のサイエンス誌に発表した。
ウイルス表面の「ノイラミニダーゼ」と呼ばれるタンパク質で、特定の3カ所に変異が起きることが原因という。新型インフルエンザが耐性を獲得して拡大するかどうかを監視するのに役立ちそうだ。
インフルエンザウイルスは細胞内に侵入して増殖し、これらが細胞表面から放出されて別の細胞に感染する。放出の際、細胞とウイルスの結合を切り離す役割を担うのがノイラミニダーゼだ。
タミフルはノイラミニダーゼの働きを妨げ、ウイルスの増殖を抑える。しかし、ノイラミニダーゼの274番目のアミノ酸が別の種類に置き換わってしまうとタミフルは効かなくなる。一方、この変異が起きると通常はウイルスの感染力は低下するが、季節性インフルエンザAソ連型はこの変異を持ちながら世界中に拡大しており、その仕組みは不明だった。
研究チームは、ノイラミニダーゼの274番目のほか、222番目と234番目のアミノ酸も変異したウイルスを細胞に感染させたところ、通常のウイルスと同等に増殖し、タミフルを加えても増え続けた。
インフルエンザウイルスのノイラミニダーゼは、感染したホスト細胞の細胞表面にある糖タンパク質末端からシアル酸を開裂する酵素で、細胞内で増殖したウイルスが細胞外に放出されるのを促進する働きがあります。
オセルタミビル(商品名:タミフル)は、ノイラミニダーゼに結合し、その働きを阻害します。オセルタミビル耐性は、多くの場合、ノイラミニダーゼの274番目のアミノ酸であるヒスチジンがチロシンに変異(H274Y)することで生じます。
研究者らは、このH274Yと呼ばれる突然変異がホスト細胞表面に到達するノイラミニダーゼの量を減少させていることを発見し、これがH274Y変異株の感染力低下の原因であることを示しました。さらに、Arg222→Gln222 (R222Q)とVal234→Met234 (V234M)という2つの変異が存在すれば、H274Yがあってもノイラミニダーゼは野生株並みに細胞表面に到達し、感染力も強いことを発見しました。
以上が、感染力を保ったまま治療薬タミフルに対する耐性を持つ仕組みなのですが、研究者らはさらに、発見された2つの二次突然変異は、耐性ウイルスの大流行の数年前から既に存在していたことを発見しました。この現象は、「H274Y変異が、R222Q変異とV234M変異をヒッチハイクした」と表現されています。
本研究は、季節性インフルエンザについての知見ですが、新型(ブタ)インフルエンザやトリインフルエンザなど、オセルタミビルが有効とされているインフルエンザの耐性株の出現を予見するためにも重要な情報を提供していると思われます。
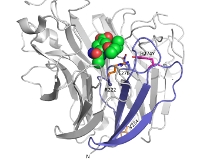
下の図は、ノイラミニダーゼの立体構造。H274Y変異はピンク、R222QとV234M変異はオレンジで示されています。緑と赤の構造は、オセルタミビル。

参考記事
タミフル耐性新型インフルエンザウイルス
下水の排水にタミフル、ウイルス耐性化の恐れも??


コメント