Small-molecule inhibition of APT1 affects Ras localization and signaling
以下は、論文の要約です。
脱パルミトイル化と再パルミトイル化のサイクルは膜と相互作用する様々なタンパク質の局在や機能を制御している。このような重要な制御を受けるタンパク質の一つががん遺伝子産物のRasである。
低分子化合物を用いてパルミトイル化などのアシル化反応を阻害することは、パルミトイル化Rasの細胞内局在をかく乱し、Rasシグナル異常をコントロールするための戦略の1つである。
本研究では、これまでその細胞機能が不明であった脱パルミトイル化を触媒するacyl protein thioesterase 1 (APT1)の強力な阻害薬の開発(knowledge-based development)と特性解析を行った。
その阻害薬、palmostatin Bは、脱パルミトイル化レベルで細胞内アシル化サイクルをかく乱し、パルミトイル化Rasの正常な細胞内局在を阻害する。
その結果、palmostatin Bは、恒常的活性型(発がん性)HRasG12Vを発現した線維芽細胞のがん細胞様表現型を部分的に回復した。このように、APT1はアシル化サイクルにおけるチオエステル化酵素の一つであり、分子標的薬の標的分子である。
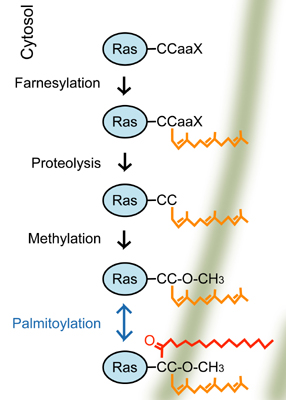
タンパク質の脂質修飾には、ミリストイル化、パルミトイル化、プレニル化、GPIアンカー化があります。これらのうち、パルミトイル化のみが可逆的で、一度パルミトイル化されたタンパク質が細胞内で脱パルミトイル化されます。
パルミトイル化は、蛋白質のシステイン残基にチオエステル結合でパルミチン酸が付加したものです。パルミチン酸は、炭素数16の飽和脂肪酸であり、哺乳動物細胞では、100種類以上のタンパク質がパルミトイル化されています。
本論文は、脱パルミトイル化酵素についてですが、パルミトイル化酵素についての研究も盛んに行われています。これまでの研究で、Rasの再パルミトイル化はゴルジでおこり、膜に安定的に結合できるようになったRasがゴルジからエキソサイトーシス経路により細胞膜へ再度送り出されることがわかっています。palmostatin Bはこのようなサイクルを乱し、ゴルジの活性化型Rasを減少させました。
APT1の構造解析から、胃のリパーゼと活性中心の立体構造が似ていることがわかり、リパーゼ阻害薬との関連で、palmostatin Bが合成されました。こういうのを”knowledge-based development”というようです。このようなやり方で、構造決定から阻害薬の合成がスムーズに行くのはどのくらいの確立なのでしょうか?
Rasは、最も有名ながん遺伝子ですが、Ras自身あるいは周辺分子を標的とする有効な分子標的薬は、まだありません。APT1阻害薬はその候補の1つのようです。
脱パルミトイル化される他のタンパク質への影響は大丈夫なのでしょうか?すこし、気になります。
Rasのパルミトイル化と脱パルミトイル化

コメント